| Investigador Principal (IP):Sobrido Gómez, María Jesús | Código:ND |
| Convocatoria: NA (Donación ACTELION Pharmaceuticals) | |
| Dotación: 25.000,00€ | |
| Duración:3 años | Fecha Inicio:01/01/13 |
| Objeto: i-(principal)determinar la prevalencia de la enfermedad de Niemann-Pick C (NPC) en la poblacion de pacientes adultos con enfermedades neurodegenerativas sin filiar atendidos en servicios de neurologia de Galicia. | ii- (secundario) evaluar la robustez y coste-eficiencia del abordaje diagnostico del NPC mediante la plataforma de ultrasecuenciacion IonPGMR®. |
| Palabras clave: Niemann-Pick C, NPC, prevalencia, enfermedades neurodegenerativas | |
EQUIPO
| Apellidos | Nombre | Titulación/ Categoría | Entidad |
| Sobrido Gómez | Mª Jesús | Medicina (especialidad Neurogenética), doctor/ IP | Instituto de Investigaciones Sanitarias de Santiago (IDIS) |
| ND | ND | ND | Servicio Galego de Saúde (SERGAS) |
OTRAS ENTIDADES COLABORADORAS
| Nombre | Nombre/ Siglas | Tipo/ Categoría |
| Actelion Pharmaceuticals Ltd. | Actelion | Empresa privada |
Resumen de la propuesta.
La enfermedad de Niemann-Pick C (NPC) es un trastorno neurodegenerativo hereditario caracterizado por un defecto del tráfico lipídico intracelular que se acompaña de una acumulación secundaria de glucoesfingolípidos. Se hereda de forma autosómica recesiva y su incidencia en Europa se estima en 1 por cada 150.000 nacidos vivos. Su origen se ha vinculado a una serie de mutaciones que pueden afectar a los genes NPC1 y/o NPC2,3 que desencadenarían un acúmulo de colesterol y glucoesfingolípidos en varios tejidos, incluído el cerebro.
Existe la sospecha de que el NPC está infra-diagnosticado y que su incidencia real puede ser superior a la reconocida actualmente. Esta situacion puede ser especialmente relevante en la poblacion adulta, ya que el estudio de esta enfermedad se ha centrado tradicionalmente en el ámbito de la pediatria y fuera de esta, la epidemiología de la enfermedad de NPC es prácticamente desconocida.
El despistaje de pacientes con sospecha de NPC se debe realizar con el objetivo final de distinguirlos de otras metabolopatías y debe fijarse tanto en el debut como en la evolución de los signos y síntomas.
Introducción y justificación.
La enfermedad de Niemann-Pick C (NPC) es un trastorno neurodegenerativo hereditario caracterizado por un defecto del tráfico lipídico intracelular, que se acompaña de una acumulación secundaria de glucoesfingolípidos. Su origen se ha vinculado a una serie de mutaciones que pueden afectar a los genes NPC1 y/o NPC2,3 que desencadenarían un acúmulo de colesterol y glucoesfingolípidos en varios tejidos, incluído el cerebro.
Existe la sospecha de que el NPC está infra-diagnosticado y que su incidencia real puede ser superior a la reconocida actualmente. Esta situación puede ser especialmente relevante en la población adulta, ya que el estudio de esta enfermedad se ha centrado tradicionalmente en el ámbito de la pediatría y fuera de ésta, la epidemiología de la enfermedad de NPC es prácticamente desconocida. Las primeras manifestaciones clínicas del NPC suelen presentarse durante la infancia, siendo diagnosticada alrededor de los 10 anos de edad. Aunque existen manifestaciones clínicas características (ictericia y/o ascitis neonatal, hepato-esplenomegalia y parálisis supranuclear de la mirada vertical entre otras), el NPC es una enfermedad con presentacion clínica muy variable.El despistaje de pacientes con sospecha de NPC se debe realizar con el objetivo final de distinguirlos de otras metabolopatías y debe fijarse tanto en el debut como en la evolución de los signos y síntomas.
El fármaco Miglustat®, es un iminoazúcar que ha demostrado enlentecer o estabilizar la progresión de los síntomas neurológicos asociados a la enfermedad. Los pacientes que empiezan la terapia con Miglustat®, cuando aparecen los primeros síntomas neurológicos, responden mejor al tratamiento. Esta situación hace especialmente interesante la detección de pacientes que podrían beneficiarse de esta terapia y que actualmente están siendo tratados de forma inadecuada con otros fármacos.
La progresión de la enfermedad y la esperanza de vida están directamente relacionadas con la aparición de los sintomas neurológicos. No se dispone de datos sólidos acerca de la prevalencia de NPC en la poblacion neurológica adulta, aunque si se conoce la existencia de clínica neurológica y visceral tanto en neonatos como en pacientes infanto-juveniles o adultos.Dado que existe un importante retraso en el diagnóstico de NPC13 (entre 6.2 + 6.5 años), el diseño elegido para este proyecto se considera el más adecuado para reevaluar aquellos pacientes con alta sospecha de NPC, en ausencia de datos epidemiológicos más detallados.
Población de estudio.
Pacientes adultos seguidos en los servicios de neurología de los hospitales del SERGAS durante el período de estudio (enero 2014 a junio 2015).
Objetivos.
General. Mejorar el diagnostico diferencial y la capacidad de deteccion de la enfermedad de NPC en unapoblacion adulta atendida por los servicios de neurologia.
Específicos.
1.- Conocer la prevalencia de NPC entre los pacientes adultos con enfermedades neurodegenerativasatendidos en los servicios de neurología de Galicia.
2.- A Determinar la validez de ciertos signos y síntomas neurológicos «guía» como factores de sospechade la enfermedad de NPC. Si resultaran válidos, evaluar el grado de relevancia de cada unode ellos y analizar si existiesen correlaciones genotipo-fenotipo.
3.- Implementar en Galicia, evaluar eficacia, especificidad y robustez de un panel deultrasecuenciación mediante la plataforma IonPGM® para el diagnóstico de la NPC.
Metodología y plan de trabajo.
- Diseño del panel de ultrasecuenciación para Ion PGM®.
- Identificación de pacientes candidatos.
- Ultrasecuenciación.
- Validación por secuenciación convencional, búsqueda de segunda mutación en casos con una única variante y análisis de patogenicidad.
- Comunicación del resultado a los participantes.
- Análisis de los datos.
Cronología del estudio.
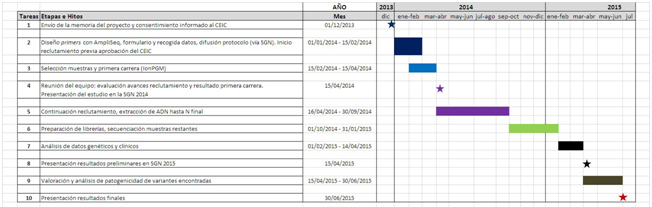
| Tareas | Etapas e Hitos | FECHA | |
| 1 | Envío de la memoria del proyecto y consentimiento informado al CEIC | 01/12/2013 | |
| 2 | Diseño primers con AmpliSeq, formulario y recogida datos, difusión protocolo (vía SGN). Inicio reclutamiento previa aprobación del CEIC | 01/01/2014 – 15/02/2014 | |
| 3 | Selección muestras y primera carrera (IonPGM) | 15/02/2014 – 15/04/2014 | |
| 4 | Reunión del equipo: evaluación avances reclutamiento y resultado primera carrera. Presentación del estudio en la SGN 2014 |
15/04/2014 | |
| 5 | Continuación reclutamiento, extracción de ADN hasta N final | 16/04/2014 – 30/09/2014 | |
| 6 | Preparación de librerías, secuenciación muestras restantes | 01/10/2014 – 31/01/2015 | |
| 7 | Análisis de datos genéticos y clínicos | 01/02/2015 – 14/04/2015 | |
| 8 | Presentación resultados preliminares en SGN 2015 | 15/04/2015 | |
| 9 | Valoración y análisis de patogenicidad de variantes encontradas | 15/04/2015 – 30/06/2015 | |
| 10 | Presentación resultados finales | 30/06/2015 |
Bibliografía (estado del arte previo a la realización del proyecto)
Pentchev PG, Comly ME, Kruth HS, y cols. Group C Niemann-Pick disease: faulty regulation of low-density lipoprotein uptake and cholesterol storage in cultured fibroblasts. Faseb J 1987; 1: 40–45.
Millat G, Marcais C, Rafi MA, y cols. Niemann-Pick C1 disease: the I1061T substitution is a frequentmutant allele in patients of Western European descent and correlates with a classic juvenilephenotype. Am J Hum Genet 1999; 65: 1321–29.
Ikonen E, Holtta-Vuori M: Cellular pathology of Niemann-Pick type C disease. Semin Cell Dev Biol2004; 15:445–454.
Garver WS, Francis GA, Jelinek D, Shepherd G, Flynn J, Castro G, Walsh Vockley C, Coppock DL,Pettit KM, Heidenreich RA, Meaney FJ. National Niemann-Pick C1 disease database: report ofclinical features and health problems. Am J Med Genet A. 2007; 143A (11):1204-11.
Sevin M, Lesca G, Baumann N, Millat G, Lyon-Caen O, Vanier MT, y cols. The adult form of Niemann-Pick disease type C. Brain 2007;130:120–33.
Patterson MC, Vecchio D, Prady H, Abel L, Wraith JE. Miglustat for treatment of Niemann-Pick C disease: a randomised controlled study. Lancet Neurol. 2007 Sep;6(9):765-72.
Pineda M, Wraith JE, Mengel E, Sedel F, Hwu WL, Rohrbach M, Bembi B, Walterfang M, Korenke GC, Marquardt T, Luzy C, Giorgino R, Patterson MC. Miglustat in patients with Niemann-Pick disease Type C (NPC): A multicenter observational retrospective cohort study. Mol Genet Metab. 2009.
Shulman LM, David NJ, Weiner WJ. Psychosis as the initial manifestation of adult-onset Niemann-Pick disease type C. Neurology. 1995 Sep;45(9):1739-43.
Josephs KA, Van Gerpen MW, Van Gerpen JA: Adult-onset Niemann-Pick disease type C presenting with psychosis. J Neurol.
Sullivan D, Walterfang M, Velakoulis D. Bipolar disorder and Niemann-Pick disease type C. Am J Psychiatry. 2005 May;162(5):1021-2.
Walterfang M, Fietz M, Fahey M, Sullivan D, Leane P, Lubman DI, Velakoulis D. The neuropsychiatry of Niemann-Pick type C disease in adulthood. J Neuropsychiatry Clin Neurosci. 2006 Spring;18(2):158-70.
Sandu S, Jackowski-Dohrmann S, Ladner A, Haberhausen M, Bachmann C. Niemann-Pick disease type C1 presenting with psychosis in an adolescent male.
Eur Child Adolesc Psychiatry. 2009 Sep;18(9):583-5.
Sevin M. et al. The adult form of Niemann-Pick disease Type C Brain 2006; 1-14
Boustany RM, Kaye E and Alroy J. Ultrastructural findings in skin from patients with Niemann-Pick disease, Type C. Pediatr Neurol 1990;6 (3):177-83
D. Carstea, J.A. Morris, K.G. Coleman, S.K. Loftus, D. Zhang, C. Cummings, J. Gu, M.A. Rosenfeld, W.J. Pavan, D.B. Krizman, J. Nagle, M.H. Polymeropoulos, S.L. Sturley, Y.A. Ioannou, M.E. Higgins, M. Comly, A. Cooney, A. Brown, C.R. Kaneski, E.J. Blanchette-Mackie, N.K. Dwyer, E.B. Neufeld, T.Y. Chang, L. Liscum, J.F. Strauss 3rd, K. Ohno, M. Zeigler, R. Carmi, J. Sokol, D.Markie, R.R. O’Neill,
O.P. van Diggelen, M. Elleder, M.C. Patterson, R.O. Brady, M.T. Vanier, P.G. Pentchev, D.A. Tagle, Niemann-Pick C1 disease gene: homology to mediators of cholesterol homeostasis, Science 277 (1997) 228–231.
Millat, N. Bailo, S. Molinero, C. Rodriguez, K. Chikh, M.T. Vanier, Niemann-Pick C disease: use of denaturing high performance liquid chromatography for the detection of NPC1 and NPC2 genetic variations and impact on management of patients and families, Mol. Genet. Metab. 86 (2005) 220–232.
Millat, K. Chikh, S. Naureckiene, D.E. Sleat, A.H. Fensom, K. Higaki, M. Elleder, P. Lobel, M.T. Vanier, Niemann-Pick disease type C: spectrum of HE1 mutations and genotype/phenotype correlations in the NPC2 group, Am. J. Hum. Genet. 69 (2001) 1013–1021.
Resultados/ Estatus actual.
Estudio en marcha.
Resultados del proyecto. Publicaciones asociadas.
ND





